IL CORTISOLO
- Che cos’è e dove viene prodotto?
- A cosa serve?
- Come si misura?
- Ritmi circadiani e ultradiani
- Patologie
- Cortisolo come biomarker dello stress
- A cosa serve misurarlo?
- In che modo il cortisolo influisce sul bilancio energetico?
- Che correlazione c’è fra alti livelli di cortisolo e ricerca di cibo?
- Restrizione calorica
- Cortisolo indotto da pasti
- Conclusioni
Che cos’è e dove viene prodotto?
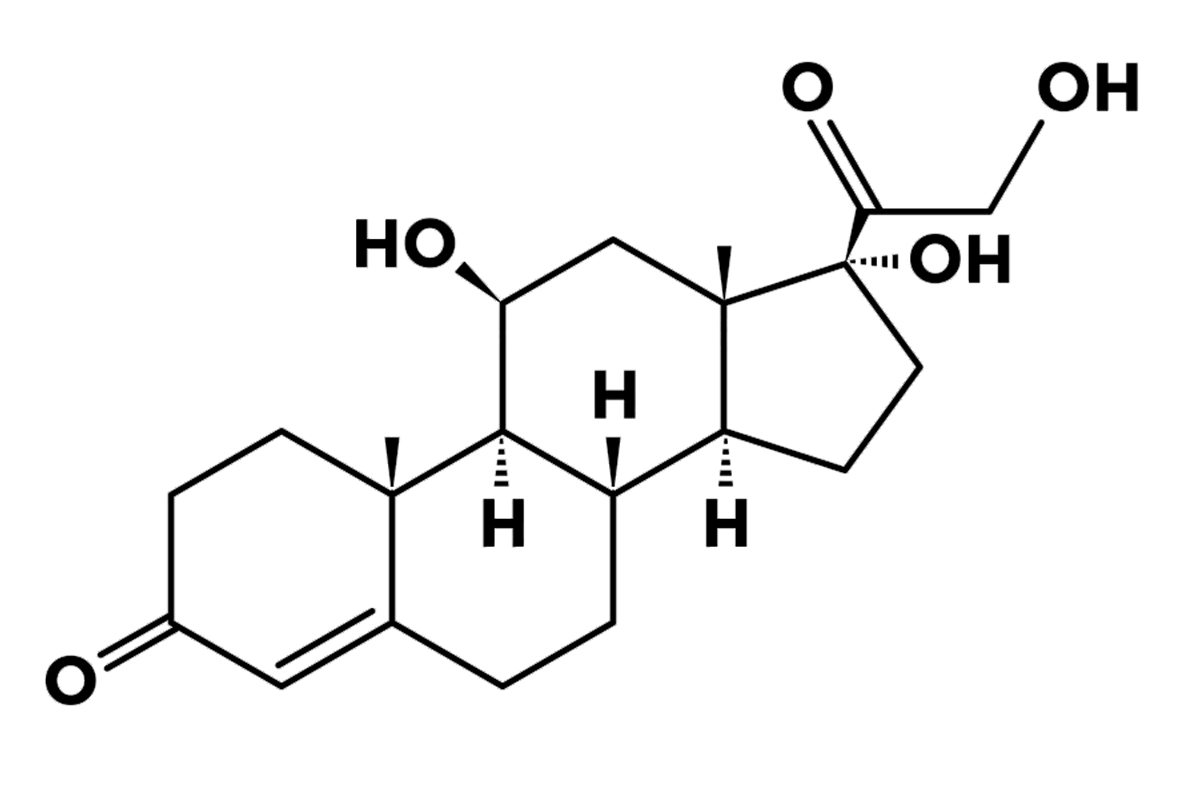
Il cortisolo è l'ormone principale appartenente alla famiglia dei glucocorticoidi, della quale fa parte anche il corticosterone, seppur in quantità minori negli esseri umani.
Classificato come ormone steroideo, il cortisolo ha come precursori gli steroli, molecole lipidiche da cui derivano anche altri ormoni come l'estradiolo, il testosterone e l'aldosterone, tutti strutturalmente caratterizzati dall'anello steranico.
La produzione di cortisolo avviene nella zona fascicolata del surrene, stimolata dall'ormone adenocorticotropo (ACTH) ipofisario.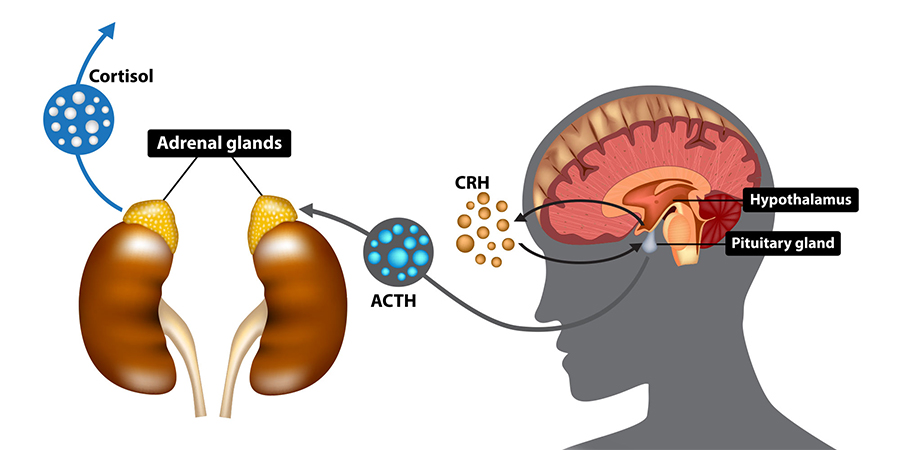
Per comprendere appieno questo meccanismo, è utile esplorare brevemente il funzionamento dell’asse ipotalamo-ipofisi-surrene (asse HPA), un sistema neuroendocrino coinvolto nella risposta allo stress, dinamicamente coordinato dal rilascio pulsatile del cortisolo.
L’ipotalamo, situato alla base del cranio, è una struttura che svolge un ruolo chiave sia nell'ambito nervoso che endocrino, contribuendo alla regolazione dell’omeostasi corporea. Attraverso la produzione dell'ormone di rilascio delle corticotropine (CRH), controlla l’ipofisi, connessa tramite una struttura chiamata infundibulo.
In risposta agli stimoli ipotalamici, l’ipofisi produce una serie di ormoni, inclusa l'adenocorticotropina (ACTH). 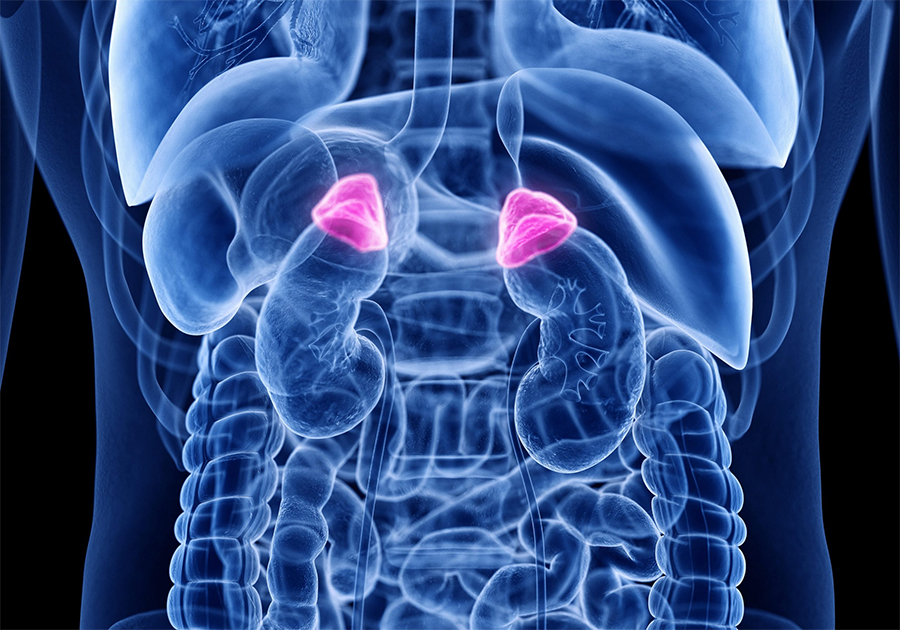
Le ghiandole surrenali, situate superiormente ai reni, si compongono di una parte centrale, la midollare, e una parte esterna, la corticale.
La midollare produce catecolammine (adrenalina e noradrenalina), responsabili di una risposta rapida e breve a situazioni di pericolo.
Queste molecole inducono adattamenti come l'accelerazione della respirazione e dei battiti cardiaci, insieme a un effetto iperglicemizzante derivante dalla mobilizzazione delle riserve di glicogeno epatico, necessario per sostenere la respirazione cellulare. 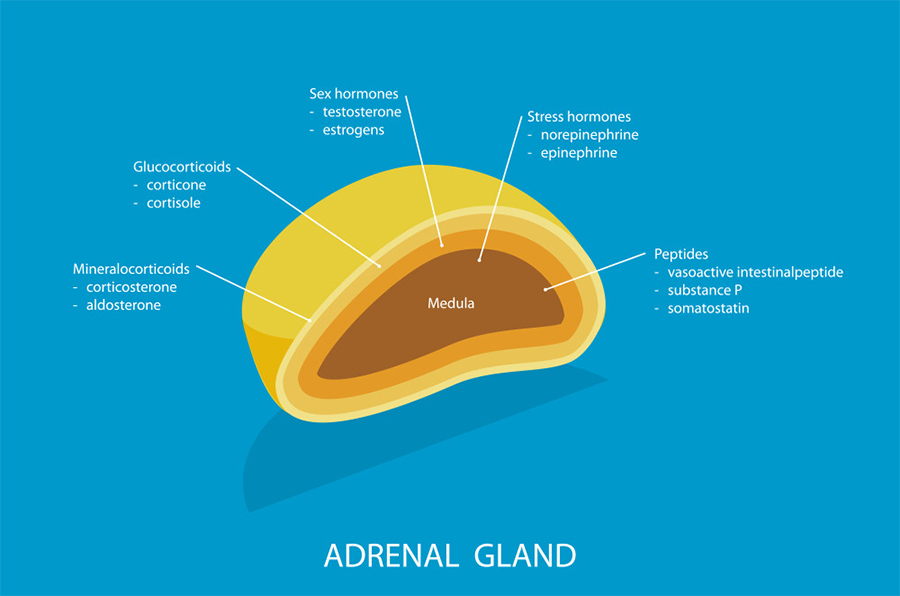
La corticale del surrene, invece, è responsabile della produzione di glucocorticoidi, i quali orchestrano una risposta lenta, prolungata e adattativa in situazioni di stress.
Il rilascio di cortisolo è strettamente controllato dall'ACTH ipofisario, che è regolato dal CRH ipotalamico.
Questo processo è soggetto a un meccanismo di feedback negativo (autoregolazione): quando i livelli di cortisolo aumentano, un segnale centrale si attiva per inibirne la produzione.
Tuttavia, durante periodi di stress cronico, il sistema ipotalamico è iper-stimolato, portando a un notevole aumento dei livelli di cortisolo.
A cosa serve?
Il cortisolo svolge un ruolo essenziale nel mantenimento della salute e del benessere, dunque eccessi o carenze nei suoi livelli possono rappresentare un problema.
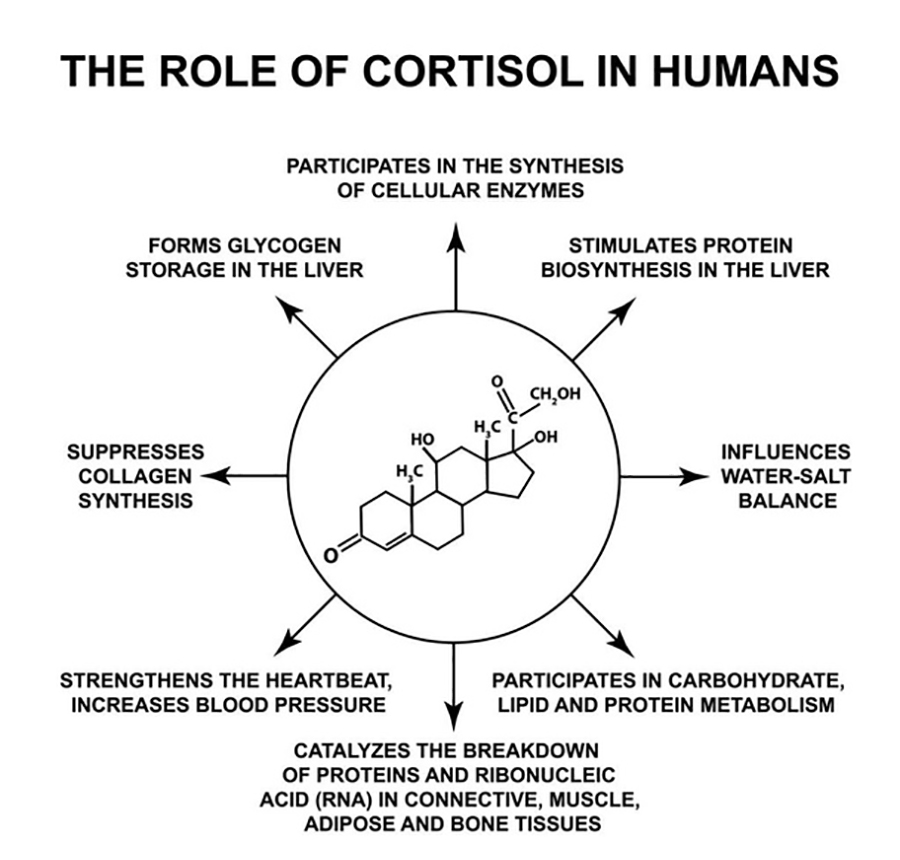
In particolare, il cortisolo stimola la gluconeogenesi, in collaborazione con il glucagone, la lisi proteica, in sinergia con l’ormone tiroideo T3 e la mobilitazione dei lipidi, soprattutto durante esercizi prolungati, insieme all’adrenalina e all’ormone della crescita (GH).
Questi processi biochimici sono fondamentali per mobilizzare le riserve energetiche necessarie, supportando reazioni di attacco o fuga e situazioni di forte stress, sia emotivo che fisico, come esami o scadenze lavorative.
Tra le funzioni secondarie del cortisolo, inoltre, troviamo:
- Regolazione del bilancio di acqua ed elettroliti, influenzando il controllo della pressione. Il cortisolo induce la sintesi dell’angiotensina, amplifica gli effetti vasopressori delle catecolammine e dell'angiotensina II, e riduce la dilatazione endoteliale mediata da ossido nitrico. Inoltre, aumenta il tasso di filtrazione glomerulare per promuovere la ritenzione di sodio e la perdita di potassio.
- Effetto anti-infiammatorio e immunosoppressivo. Riduce la conta e induce l’apoptosi linfocitaria, inibisce la sintesi degli anticorpi, prevenendo l’infiammazione citochinaria. Inoltre, inibisce la differenziazione dei monociti in macrofagi e sopprime l’infiammazione locale attraverso una minore produzione di istamina e una concomitante ridotta sintesi di prostaglandine. Pertanto, in risposta a infezioni o traumi, il cortisolo agisce per stabilizzare i meccanismi omeostatici adattativi, prevenendo una reazione incontrollata del sistema immunitario.
Come si misura?
Una parte considerevole del cortisolo, essendo una molecola lipofila, deve essere trasportata nel circolo ematico legata a un trasportatore, noto come transcortina, o globulina legante i corticosteroidi (CBG), circa 80%, o all’albumina (10%). Circa il 10% circola liberamente nel plasma ed è considerato biologicamente attivo.
I metodi più comuni per misurare i suoi livelli includono la prova del cortisolo sierico, che potrebbe tuttavia produrre risultati compromessi in presenza di concentrazioni alterate di proteine plasmatiche. In casi di ipercortisolismo, come nella sindrome di Cushing, si preferisce usare il cortisolo libero urinario nelle 24 ore.
Altre metodologie ampiamente utilizzate e validate sono il cortisolo salivare e quello rilevato dai capelli, che potrebbero risultare utili nell’identificazione dei biomarkers nello stress cronico.
Raramente i livelli di cortisolo sierico sono impiegati nella diagnostica. Tuttavia, concentrazioni fra 450-550 nmol/L escluderebbero malfunzionamenti della corticale, concentrazioni inferiori a 140 nmol/L suggeriscono invece insufficienza della corticale, specialmente se associate a valori di ACTH plasmatico superiori a 66pmol/L, avvalorando maggiormente il quadro clinico.
In ogni caso, i test più informativi per stabilire una disfunzione surrenalica sono quelli che stimolano/sopprimono l’asse HPA.
Ritmi circadiani e ultradiani
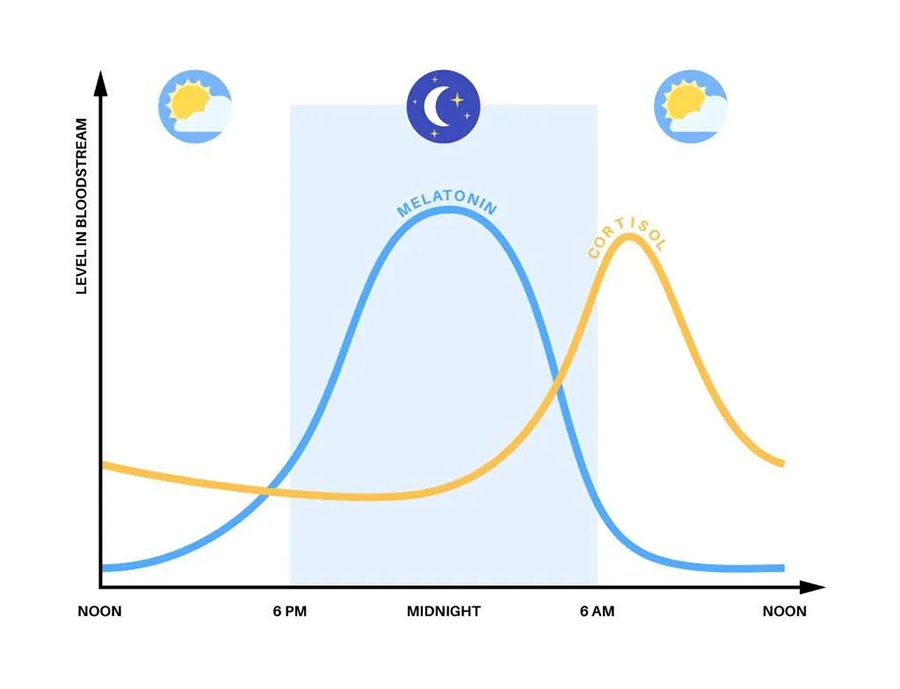
Sia ACTH che CRH seguono un pattern di rilascio pulsatile circadiano (all’interno delle 24 h).
Un soggetto sano, adulto e non stressato produce circa una ventina di pulsazioni all’interno di questo periodo, iniziando con pulsazioni ampie tra le 3 e le 9 di mattina a intervalli di 90 minuti.
Il picco massimo si verifica fra le 7 e le 11, con una diminuzione della frequenza dalle 18 a mezzanotte.
Di conseguenza, il cortisolo segue lo stesso andamento, raggiungendo la massima concentrazione al mattino presto (alle 8) e il livello minimo durante la notte (00-3).
La sua ritmicità è cruciale, pertanto l’orario di misurazione è un fattore importante da tenere in considerazione.
Patologie
Va sottolineato che la ritmicità del cortisolo può essere compromessa da una serie di fattori disturbanti, tra cui insonnia, turni di lavoro, etnicità, sesso, età, BMI e fase del ciclo mestruale.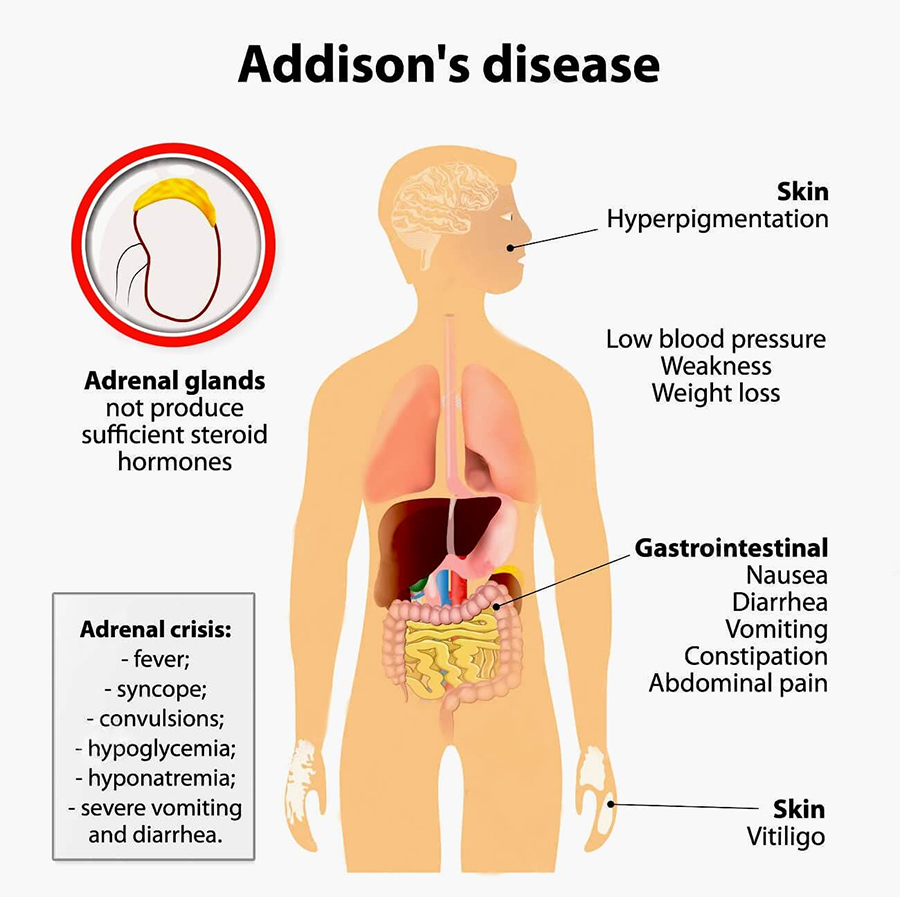
Quando i livelli di cortisolo raggiungono valori plasmatici estremamente bassi, si parla di ipocortisolismo, associata alla sindrome di Addison, che si manifesta con sintomi quali fatica e perdita di peso.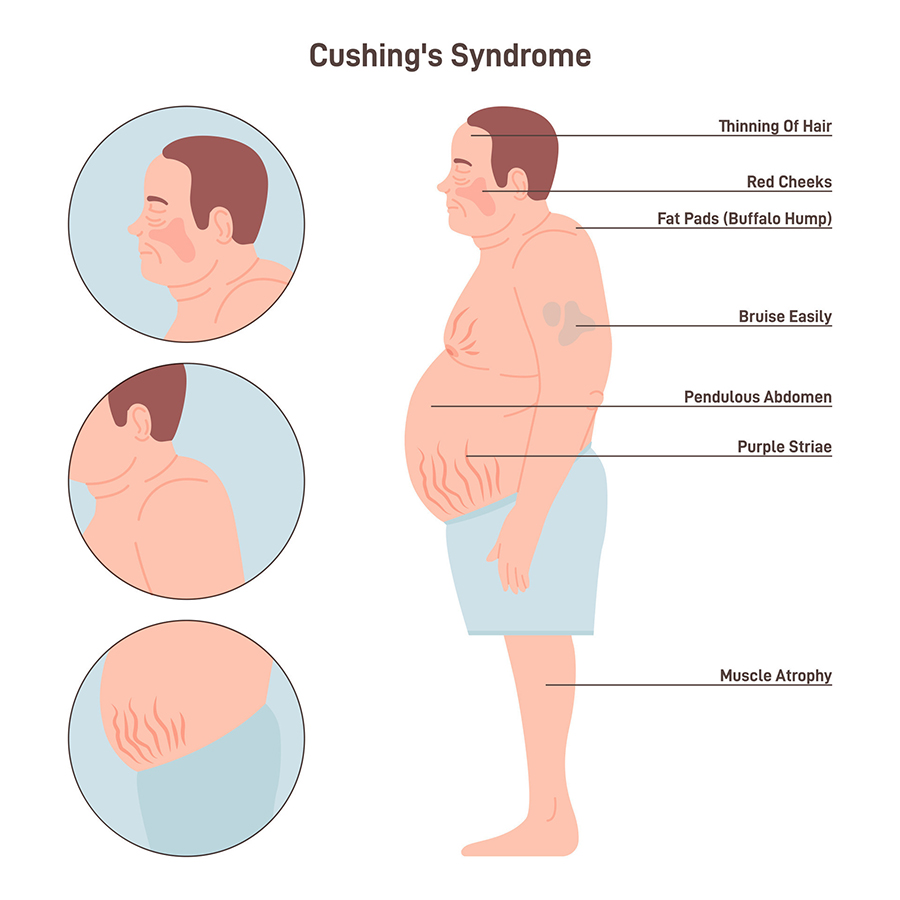
Al contrario, livelli plasmatici eccessivamente alti indicano l’ipercortisolismo, correlata alla sindrome di Cushing, che può comportare ipertensione, resistenza insulinica, iperglicemia e rapido aumento di peso.
Cortisolo come biomarker dello stress

Lo stress è uno sbilancio dell’equilibrio omeostatico all’interno dell’organismo, originariamente un termine ingegneristico che indicava una forza che produce deformazione di un corpo.
Il corpo umano, tuttavia, non funziona come un sistema chiuso.
Pertanto, non è corretto considerare lo stress solo in chiave negativa, perché il nostro organismo è continuamente influenzato dall’ambiente sia interno che esterno (agenti patogeni, meteo, patologie, allenamento, ecc.) alle quali risponde adattandosi, rimodulando le risposte interne.
Il concetto chiave è l’allostasi, dove il corpo, in risposta a stimoli di vario tipo, mette attivamente in pratica interventi di adattamento per raggiungere una nuova stabilità e mantenere risposte fisiologiche normali.
Tuttavia, quando l’allostasi diventa maladattativa, come in condizioni di stress prolungato o determinati stati patologici, possono verificarsi alterazioni regolatorie.
In queste circostanze, il comportamento oscillatorio tipico del cortisolo può subire modifiche, così come le concentrazioni stesse.
A cosa serve misurarlo?

Sebbene i biomarkers dello stress acuto siano ben riconosciuti nel rilascio di catecolammine (adrenalina e noradrenalina), la comprensione dello stress cronico è più complessa, coinvolgendo molteplici variabili individuali.
Esistono comunque biomarkers del "carico allostatico" che possono essere utili come indicatori e predittori di patologie imminenti.
L'aumento del cortisolo circolante durante lo stress, sia psicologico che fisico, induce risposte adattative attraverso processi catabolici, fornendo energia al corpo.
Tuttavia, il cortisolo dovrebbe normalmente ritornare ai livelli basali. In situazioni di stress prolungato, i livelli persistentemente alti possono portare a danni all'ippocampo e ai neuroni corticali, causando ipercortisolismo anche dopo la cessazione dello stimolo stressante.
La misurazione del cortisolo può quindi essere utile per identificare stati patologici cronici o pre-patologici.
Tuttavia, va notato che ci sono limitazioni nei metodi di misurazione direttamente correlati alla sua caratteristica pulsatile, che possono falsare i valori.
Pertanto, le strategie adottabili includono la misurazione salivare in condizioni standard e il confronto nel tempo o l'analisi dell'andamento temporale nei capelli, una tecnica ancora emergente, ma promettente.
In che modo il cortisolo influisce sul bilancio energetico?

Come menzionato in precedenza, livelli elevati di cortisolo nel sangue sono associati a un aumento del peso corporeo, poiché i glucocorticoidi favoriscono la differenziazione degli adipociti e stimolano l'accumulo di grasso nel tessuto adiposo.
In particolare, è emerso che solo nei soggetti con un eccessivo accumulo di grasso viscerale nell'area addominale si manifesta una disfunzione nel meccanismo di regolazione a feedback negativo dell'asse HPA.
Questa condizione è correlata anche ad aumentata pressione sanguigna, resistenza insulinica e dislipidemia.
Al contrario, nei soggetti con una distribuzione più periferica del grasso, non si osservano situazioni di ipercortisolismo o resistenza al cortisolo a livello ipotalamico.
Che correlazione c’è fra alti livelli di cortisolo e ricerca di cibo?

Un articolo intrigante pubblicato su Physiology & Behavior nel 2008 ha esaminato l'associazione tra l'obesità addominale di tipo androide e le alterazioni nell'asse HPA.
Sebbene non sia ancora chiaro se questa connessione sia una causa o una conseguenza, diversi studi confermano che l’asse HPA è coinvolto nella regolazione del peso in esseri umani che presentano accumulazione di grasso viscerale.
Infatti, la letteratura scientifica presenta diversi casi che evidenziano l'impatto dello stress sulla ricerca di cibo.
Tuttavia, interpretare tali risultati in modo univoco è complesso a causa della vasta gamma di fattori stressanti e delle differenze individuali nella risposta al cortisolo durante lo stress.
Malgrado ciò, è emerso che le donne con alti livelli di cortisolo mostrano un aumento nell'assunzione di cibo indotto dallo stress, suggerendo una correlazione tra la risposta al cortisolo e il consumo alimentare.
Studi condotti su animali, successivamente confermati da ricerche limitate sull'uomo, hanno dimostrato che i glucocorticoidi, inclusi il cortisolo, hanno un effetto stimolante sull'appetito (effetto oressigenico), indicando che lo stress può influenzare positivamente la fame e la ricerca di cibo.
Inoltre, la fame indotta dal cortisolo sembra orientarsi verso i carboidrati, ma in presenza di alti livelli di insulina, si sposta verso cibi grassi e appetibili. In situazioni stressanti, l'istinto primordiale spinge verso piccoli snack energetici, più facili da consumare e digerire quando la funzionalità del sistema digestivo è ridotta in preparazione a una risposta di "combatti o fuggi".
Restrizione calorica
Diversi studi hanno rivelato che i livelli di cortisolo salivare erano significativamente più alti nelle donne che seguivano una dieta restrittiva rispetto a coloro che non regolavano in modo consapevole il loro consumo alimentare.
Anche se è necessario approfondire questo fenomeno con ulteriori ricerche, non si può escludere che lo stress derivante da una restrizione calorica porti all'attivazione dell'asse HPA.
È ben noto che un approccio dietetico caratterizzato da restrizioni continue può agire come un fattore di stress psicologico cronico, spesso causando iperfagia, probabilmente a causa delle alterazioni nell'asse HPA.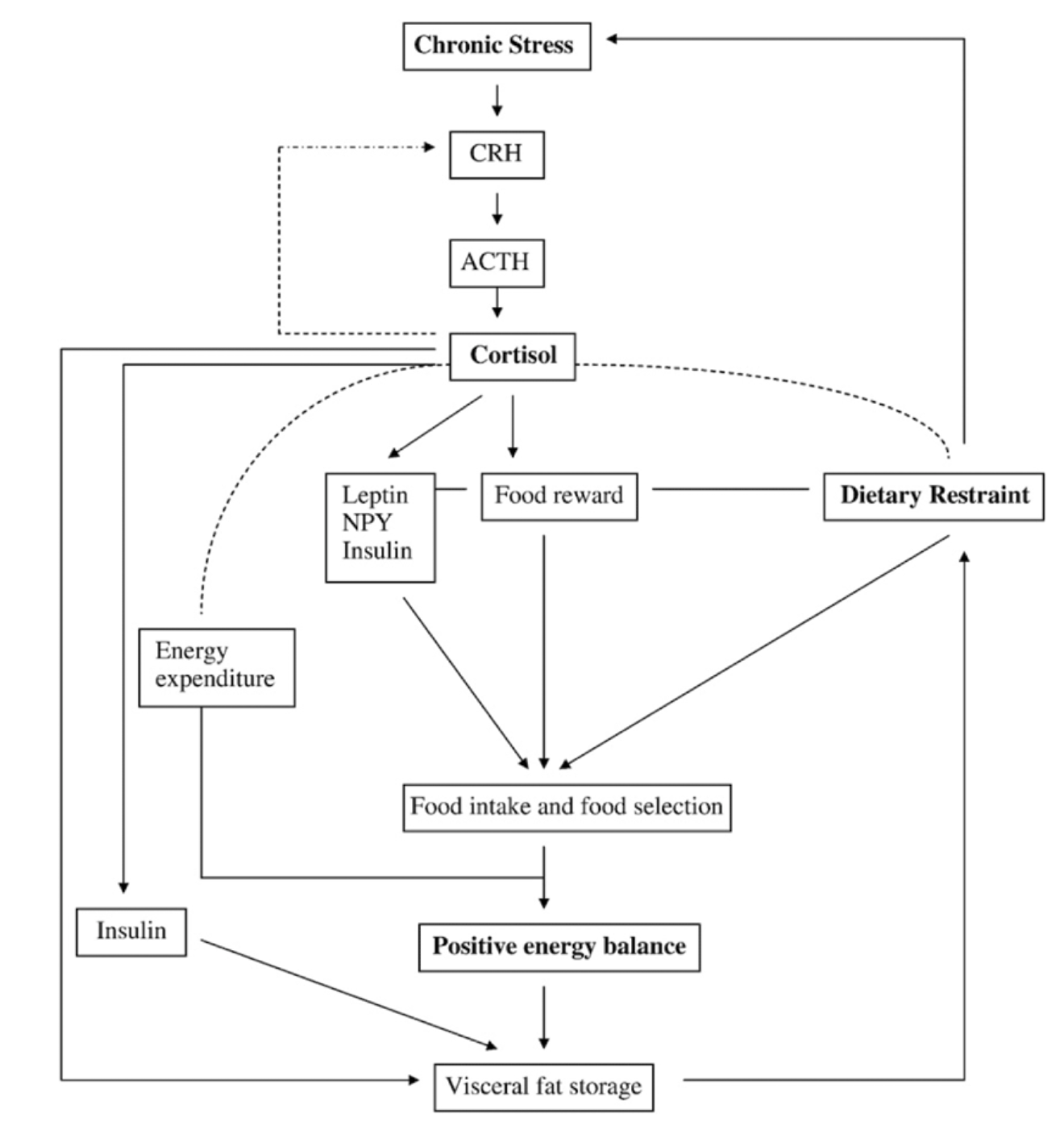
Quindi, secondo la proposta di Nieuwenhuizen e Rutters, un'iperattività costante dell'asse HPA può avviare un ciclo negativo: lo stress induce la ricerca di "comfort food" ricco di zuccheri, generando a sua volta stress, il quale intensifica ulteriormente l'attività dell'asse HPA e, di conseguenza, le concentrazioni di cortisolo, come evidenziato nello schema.
Ciò mette in luce come lo stress cronico rappresenti un importante fattore di rischio per l'accumulo di grasso viscerale, soprattutto in un contesto caratterizzato da elevati livelli di stress ambientale e dalla facile accessibilità a cibi ricchi di grassi e zuccheri.
Cortisolo indotto da pasti

Un aspetto fondamentale da esplorare per futuri sviluppi clinici riguarda la risposta del cortisolo all'assunzione di specifici pasti.
Attualmente, gli studi disponibili sono limitati, ma finora si è constatato che un pasto ricco di carboidrati provoca un notevole aumento dei livelli di cortisolo nelle donne obese a livello viscerale, rispetto a un pasto ad alto contenuto di proteine e grassi.
Inoltre, uno studio sui topi ha dimostrato che una dieta ricca di proteine riduce i livelli di cortisolo.
Il progetto di intervento proposto da Martens et al mira a identificare una composizione di macronutrienti che possa relativamente ridurre i livelli di cortisolo e, di conseguenza, favorire la perdita di peso.
Sono stati somministrati tre tipi di pasti sotto forma di bevanda, ognuno contenente un diverso macronutriente (carboidrati, grassi e proteine), mentre l'acqua è stata utilizzata come controllo.
In linea con il primo studio citato, si è osservato che l'assunzione di carboidrati previene la diminuzione dei livelli di cortisolo nel sangue rispetto alle condizioni di controllo, mentre la sua diminuzione non è stata influenzata dall'assunzione di proteine o grassi. 
Nonostante ci siano studi contraddittori sull'attivazione dell'asse HPA, alcuni associando l'attivazione a pasti ricchi di carboidrati e altri a pasti ricchi di proteine, se l'attivazione effettiva dell'asse HPA fosse correlata all'assunzione di carboidrati, potrebbe spiegare il circolo vizioso che si verifica in condizioni di stress, spesso seguito dal consumo di "comfort food" ricco di zuccheri, il quale genera ulteriore stress e una successiva attivazione dell'asse HPA, con conseguente aumento dei livelli di cortisolo.
Dopo un pasto ricco di carboidrati, si verifica anche un aumento dell'insulina, ma l'incremento del cortisolo può ridurne l'efficacia nel regolare i livelli di glucosio nel sangue, rallentando il processo.
Inoltre, l'aumento della glicemia potrebbe influenzare la serotonina, che, a sua volta, induce l'aumento del cortisolo e amplifica la sensazione di piacere.
Questo potrebbe spiegare il meccanismo alla base del consumo di cibi ricchi di carboidrati durante situazioni di stress.
Conclusioni
In conclusione, il cortisolo svolge un ruolo cruciale nel corretto funzionamento del metabolismo energetico e nella risposta agli stimoli esterni.
Tuttavia, alterazioni nelle sue concentrazioni, sia in eccesso che in difetto, possono contribuire alla manifestazione di patologie.
Questo articolo ha esplorato dettagliatamente il suo coinvolgimento nel bilancio energetico e la sua correlazione con situazioni di stress, evidenziando come in alcuni individui possa influire sulla ricerca di cibo.
 Contattaci su WhatsApp
Contattaci su WhatsApp